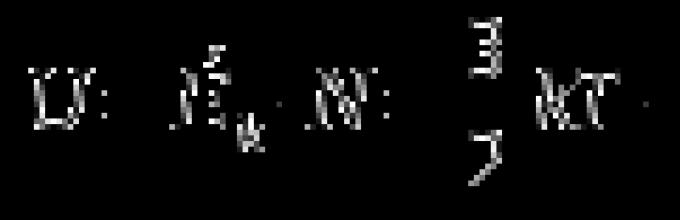Тема: Внутренняя энергия идеального газа
Цель урока: повторить понятия внутренней энергии, идеального газа, вывести формулу для определения внутренней энергии идеального газа, рассмотреть изменение внутренней энергии во всех изопроцессах, происходящих в идеальном газе.
Ход урока
Организационный момент
Деятельность учителя
Здравствуйте, девчонки! Садитесь!
Сегодня у нас очередной урок физике. Вы готовы окунуться в мир физике на 45 минут?
Какие цели мы ставим на данном уроке, и какие задачи мы будем решать?
Цели: изучение новой темы, применение полученных знаний при решении задач. Задачи: развитие творческих и исследовательских способностей, повышение интереса к физике.
Повторение изученного материла. Проверка домашнего задания (13-15 мин).
Деятельность учителя
Предполагаемая деятельность учащихся
Сегодня проверка изученного материала и будет следующим образом.
Очередность высвечивания заданий и их проверка.
1. Проверка тестов.
2. Проверка решения качественных задач.
3. проверка количественных задач
4. Проверка графических задач
5.Проверка работ виртуальной лаборатории
6. видео ролик эксперимента
Вопрос: почему вода в цилиндре поднимается? Причина подъема воды?
Сегодня мы с вами рассмотрим внутреннюю энергию и изменение внутренней энергии в термодинамике.
Значит тема нашего урока?
Пишем сегодняшнее число и тему урока «Внутренняя энергия идеального газа»
1. группа 3-4 учащиеся выполняют экспериментальную работу. Проверка закона Гей-Люссака. Оборудование: термометр, горящая вода, холодная вода, цилиндр, пластилин, 2 стакана, линейка. Минивидеоролик эксперимента. Вычисления фото и видео передаем в Viber .
2. 1 -2 ученика должны составить вычислительную задачу средней сложности на применение газовых законов, сфотографировать и передать в Viber .
3. 1 -2 ученика должны в интернете найти качественную задачу на тему газовые законы и решить, Передать Viber .
4. 1 -2 ученика должны составить в график изопроцессов в V = V (Т) и перечертить в Р=Р(V ). Чертежи нарисовать на доске.
5. 1 -2 ученика должны выполнить работу по виртуальной лаборатории. СПбГУ
6. Остальные выполняют тестовые задания, по завершению которой включаются в работу по проверке выполненного задания другими учащимися, представленные на доске.
Уменьшение температуры воздуха внутри цилиндра;
Внутренняя энергия
Изучение нового материала (13-15 мин).
Деятельность учителя
Предполагаемая деятельность учащихся
Что такое внутренняя энергия?
Идеальный газ?
Свойства идеального газа
Вывод формулы внутренней энергии одноатомного идеального газа.
![]()
Формула внутренней энергии для одноатомного идеального газа. Одноатомные газы: гелий, неон, аргон.
Формула внутренней энергии для двухатомного идеального газа. Двухатомные газы: кислород, водород, азот
Формула внутренней энергии для многоатомного идеального газа. Многоатомные газы: углекислый газ, пар и т.д
Общая формула внутренней энергии идеального газа :
Изменение внутренней энергии идеального газа
:
![]()
Какие изопроцессы мы с вами рассматривали, и определите изменение внутренней энергии в этих процессах.
Внутренняя энергия – потенциальная и кинетическая энергии всех молекул данного тела
Идеальный газ – это газ, межмолекулярные взаимодействия которого пренебрежимо мало.
1) межмолекулярные взаимодей-ствия отсутствуют: потенциальная энергия молекул идеального газа равна нулю;
2) взаимодействия происходят только при их соударениях, удары абсолютно упругие;
3) молекулы идеального газа – материальные точки
Отвечают на вопросы, участвуют в выводе формулы
Делают записи, расписывают физические величины
Изотермический процесс :
Изобарный процесс:
![]()
Изохорный процесс:
![]()
4. Закрепление изученного материала (15-17 мин)
Деятельность учителя
Предполагаемая деятельность учащихся
Задача:
Воздух массой 15 кг нагрели от температуры 100 о С до температуры 250 о С при постоянном давлении. Найдите изменение его внутренней энергии?
Учащиеся получают на электронную почту тест и решают задачи из теста самостоятельно
После завершения теста, ответы в автоматическом режиме высвечиваются на компьютере учителя
1 ученик оформляет решение задачи на доске. При решении применяется формула изменения внутренней энергии.
Учащиеся открывают почту решают тестовые задания.
5. Подведение итогов. Домашнее задание.
1Тест. Газовые законы
* Обязательно
Фамилия и имя *
В каком агрегатном состоянии вещества его молекулы хаотично движутся со средней скоростью 100 м/с *
в газообразном и жидком
только в газообразном
в жидком и твердом
в газообразном и твердом
Разряженный углекислый газ изобарно расширяется. Масса газа постоянна. Как надо изменить абсолютную температуру газа, чтобы увеличить его объем в 4 раза? *
повысить в 16 раз
повысить в 4 раза
понизить в 16 раз
понизить в 4 раза
Из стеклянного сосуда выпускают сжатый воздух, одновременно нагревая сосуд. При этом абсолютная температура воздуха в сосуде повысилась в 2 раза, а его давление увеличилось в 3 раза. Масса воздуха в сосуде уменьшилась в *
6 раз
3 раза
1,5 раза
2 раза
Согласно современным представлениям ядро атома углерода состоит из... *
электронов и протонов
нейтронов и позитронов
одних протонов
протонов и нейтронов
В баллоне находится 36*10^26 молекул газа. Какое примерно количество вещества в баллоне? *
6 моль
36 моль
6 кмоль
36 кмоль
2 Тест. Внутренняя энергия
Начало формы
Фамилия и имя
В каком из представленных примеров механическая энергия превращается во внутреннюю?
Кипение воды на газовой конфорке
попадание пули в мишень
двигатель внутреннего сгорания
нагревание металлической проволоки в пламени костра
Вариант 5
10 моль разряженного гелия находится в сосуде при давлении выше атмосферного. Как изменится внутренняя энергия газа, если в сосуде сделать небольшое отверстие и его температуру поддерживать постоянной
увеличится
уменьшится
не изменится
Как изменится внутренняя энергия воды в процессе ее нагревания от 25 С до 50 С?
не изменится, т.к. не образуется кристаллическая решетка
не изменяется, т.к. вода не кипит
растет, т.к. температура увеличивается
убывает, т.к. температура увеличивается
Идеальный газ изобарно сжимают. Как при этом изменяется внутренняя энергия газа?
увеличивается
уменьшается
не изменяется
Как изменилась внутренняя энергия газа при медленном изотермическом сжатии на 0,2 куб.м. газа, находившегося в исходном состоянии под давлением 200 кПа? Ответ округлите до целых чисел.
Конец формы
Начало формы
При изучении тепловых явлений наряду с механической энергией тел вводится новый вид энергии - внутренняя энергия. Вычислить внутреннюю энергию идеального газа не составляет большого труда.
Наиболее прост по своим свойствам одноатомный газ, т. е. газ, состоящий из отдельных атомов, а не молекул. Одноатомными являются инертные газы - гелий, неон, аргон и др. Можно получить одноатомный (атомарный) водород, кислород и т. д. Однако такие газы будут неустойчивыми, так как при столкновениях атомов образуются молекулы Н 2 , О 2 и др.
Молекулы идеального газа не взаимодействуют друг с другом, кроме моментов непосредственного столкновения. Поэтому их средняя потенциальная энергия очень мала и вся энергия представляет собой кинетическую энергию хаотического движения молекул. Это, конечно, справедливо, если сосуд с газом покоится, т. е. газ как целое не движется (его центр масс находится в покое). В этом случае упорядоченное движение отсутствует и механическая энергия газа равна нулю. Газ обладает энергией, которую называют внутренней.
Для вычисления внутренней энергии идеального одноатомного газа массой т нужно умножить среднюю энергию одного атома, выражаемую формулой (4.5.5), на число атомов. Это число равно произведению количества вещества на постоянную Авогадро N A .
Умножая
выражение (4.5.5) на
 ,
получим
внутреннюю энергию идеального одноатомного
газа:
,
получим
внутреннюю энергию идеального одноатомного
газа:
 (4.8.1)
(4.8.1)
Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре. От объема газа она не зависит. Внутренняя энергия газа представляет собой среднюю кинетическую энергию всех его атомов.
Если
центр масс газа движется со скоростью
v
0
,
то
полная энергия газа равна сумме
механической (кинетической) энергии
 и внутренней энергииU
:
и внутренней энергииU
:
 (4.8.2)
(4.8.2)
Внутренняя энергия молекулярных газов
Внутренняя энергия одноатомного газа (4.8.1) - это по существу средняя кинетическая энергия поступательного движения молекул. В отличие от атомов молекулы, лишенные сферической симметрии, могут еще вращаться. Поэтому наряду с кинетической энергией поступательного движения молекулы обладают и кинетической энергией вращательного движения.
В классической молекулярно-кинетической теории атомы и молекулы рассматриваются как очень маленькие абсолютно твердые тела. Любое тело в классической механике характеризуется определенным числом степеней свободы f - числом независимых переменных (координат), однозначно определяющих положение тела в пространстве. Соответственно число независимых движений, которые тело может совершать, также равно f . Атом можно рассматривать как однородный шарик с числом степеней свободы f = 3 (рис. 4.16, а). Атом может совершать только поступательное движение по трем независимым взаимно перпендикулярным направлениям. Двухатомная молекула обладает осевой симметрией (рис. 4.16, б) и имеет пять степеней свободы. Три степени свободы соответствуют ее поступательному движению и две - вращательному вокруг двух осей, перпендикулярных друг другу и оси симметрии (линии, соединяющей центры атомов в молекуле). Многоатомная молекула, подобно, твердому телу произвольной формы, характеризуется шестью степенями свободы (рис. 4.16, в); наряду с поступательным движением молекула может совершать вращения вокруг трех взаимно перпендикулярных осей.

От числа степеней свободы молекул зависит внутренняя энергия газа. Вследствие полной беспорядочности теплового движения ни один из видов движения молекулы не имеет преимущества перед другим. На каждую степень свободы, соответствующую поступательному или вращательному движению молекул, приходится одна и та же средняя кинетическая энергия. В этом состоит теорема о равномерном распределении кинетической энергии по степеням свободы (она строго доказывается в статистической механике).
Средняя
кинетическая энергия поступательного
движения молекул равна
 .
Поступательному
движению соответствуют три степени
свободы. Следовательно, средняя
кинетическая энергия
.
Поступательному
движению соответствуют три степени
свободы. Следовательно, средняя
кинетическая энергия
 ,
приходящаяся на одну степень свободы,
равна:
,
приходящаяся на одну степень свободы,
равна:
 (4.8.3)
(4.8.3)
Если эту величину умножить на число степеней свободы и число молекул газа массой т, то получится внутренняя энергия произвольного идеального газа:
 (4.8.4)
(4.8.4)
Эта формула отличается от формулы (4.8.1) для одноатомного газа заменой множителя 3 на множитель f .
Внутренняя энергия идеального газа прямо пропорциональна абсолютной температуре и не зависит от объема газа.
Любое тело или предмет обладают энергией. Например, летящий самолет или падающий шар обладают механической энергией. В зависимости от взаимодействия с внешними телами различают два вида механической энергии: кинетическая и потенциальная. Кинетической энергией обладают все предметы, которые тем или иным способом движутся в пространстве. Это самолет, птица, летящий в ворота мяч, перемещающийся автомобиль и др. Вторым видом механической энергии является потенциальная. Этой энергией обладают, например, поднятый камень или мяч над поверхностью земли, сжатая пружина и т.п. При этом кинетическая энергия тела может переходить в потенциальную и наоборот.
Самолеты, вертолет и дирижабль обладают кинетической энергией

Сжатая пружина обладает потенциальной энергией
Рассмотрим пример. Тренер поднимает мяч и держит его в руках. При этом мяч обладает потенциальной энергией. Когда тренер бросает мяч на землю, то у него появляется кинетическая энергия, пока он летит. После того, как мяч отскакивает, также происходит перетекание энергии до тех пор, пока мяч не будет лежать на поле. В этом случае и кинетическая и потенциальная энергии равны нулю. Но у мяча при этом повысилась внутренняя энергия молекул из-за взаимодействия с полем.
Но существует еще внутренняя энергия молекул тела, например, того же мяча. Пока мы его перемещаем или поднимаем, внутренняя энергия не изменяется. Внутренняя энергия не зависит от механического воздействия или движения, а зависит только от температуры, агрегатного состояния и других особенностей.
В каждом теле имеется множество молекул, они могут обладать как кинетической энергией движения, так и потенциальной энергией взаимодействия. При этом внутренняя энергия является суммой энергий всех молекул тела.
Как изменить внутреннюю энергию тела
Внутренняя энергия зависит от скорости движения молекул в теле. Чем быстрее они движутся, тем выше энергия тела. Обычно это происходит при нагревании тела. Если же мы его охлаждаем, то происходит обратный процесс - внутренняя энергия уменьшается.
Если мы нагреваем кастрюлю при помощи огня (плиты), то мы совершаем над этим предметом работу и, соответственно, изменяем его внутреннюю энергию.
Внутреннюю энергию можно изменить двумя основными способами. Совершая работу над телом, мы увеличиваем его внутреннюю энергию и наоборот, если тело совершает работу, то его внутренняя энергия уменьшается. Вторым способом изменения внутренней энергии является процесс теплопередачи. Обратите внимание, что во втором варианте над телом не совершается работы. Так, например, нагревается стул зимой, стоящий рядом возле горячей батареи. Теплопередача всегда происходит от тел с более высокой температурой к телам с меньшей температурой.
Таким образом, зимой нагревается воздух от батарей. Проведем небольшой эксперимент, который можно выполнить в домашних условиях. Наберите стакан горячей воды и поставьте его в чашу или контейнер с холодной. Через время температура воды в обоих сосудах станет одинаковой. Это и является процессом теплопередачи, то есть изменения внутренней энергии без совершения работы. Существует три способа теплопередачи:
Термодинамика как дисциплина сформировалась к середине 19-го столетия. Это произошло после открытия закона о сохранении энергии. Существует определенная связь между термодинамикой и молекулярной кинетикой. Какое место в теории занимает внутренняя энергия? Рассмотрим это в статье.
Статистическая механика и термодинамика
Исходной научной теорией о тепловых процессах стала не молекулярно-кинетическая. Первой была термодинамика. Она сформировалась в процессе изучения оптимальных условий применения теплоты для осуществления работы. Это случилось в середине 19-го столетия, до того как молекулярная кинетика получила признание. На сегодняшний день в технике и науке применяется как термодинамика, так и молекулярно-кинетическая теория. Последняя в теоретической физике именуется статистической механикой. Она наряду с термодинамикой исследует с применением различных методов одинаковые явления. Эти две теории взаимно дополняют друг друга. Основа термодинамики составлена двумя ее законами. Оба они касаются поведения энергии и установлены опытным путем. Законы эти справедливы для любого вещества вне зависимости от внутреннего строения. Более глубокой и точной наукой считается статистическая механика. По сравнению с термодинамикой она представляет большую сложность. Ее применяют в том случае, когда термодинамические соотношения оказываются недостаточными для объяснения исследуемых явлений.

Молекулярно-кинетическая теория
К середине 19-го века было доказано, что наряду с механической существует и внутренняя энергия макроскопических тел. Она входит в баланс энергетических природных превращений. После того как была открыта внутренняя энергия, было сформулировано положение о ее сохранении и превращении. В то время как шайба, скользящая по льду, останавливается под воздействием силы трения, ее кинетическая (механическая) энергия не просто перестает существовать, но и передается молекулам шайбы и льда. При движении неровности поверхностей тел, подвергающихся трению, деформируются. При этом интенсивность движущихся беспорядочно молекул возрастает. При нагревании обоих тел возрастает внутренняя энергия. Нетрудно пронаблюдать и обратный переход. При нагревании воды в закрытой пробирке внутренняя энергия (и ее, и образующегося пара) начинает возрастать. Давление увеличится, в результате чего пробка будет вытеснена. Внутренняя энергия пара станет причиной увеличения кинетической энергии. В процессе расширения пар совершает работу. При этом его внутренняя энергия уменьшается. В итоге происходит охлаждение пара.

Внутренняя энергия. Общая информация
При беспорядочном движении всех молекул сумма их кинетических энергий, а также потенциальных энергий их взаимодействий составляет внутреннюю энергию. Учитывая положение молекул относительно друг друга и их движение, вычислить эту сумму практически невозможно. Это обусловлено огромным количеством элементов в макроскопических телах. В связи с этим необходимо уметь вычислять значение в соответствии с макроскопическими параметрами, которые можно измерить.
Одноатомный газ
Вещество считается достаточно простым по своим свойствам, поскольку состоит из отдельных атомов, а не молекул. К одноатомным газам относят аргон, гелий, неон. Потенциальная энергия в данном случае равна нулю. Это обусловлено тем, что молекулы в идеальном газе друг с другом не взаимодействуют. Кинетическая энергия беспорядочного молекулярного движения является определяющей для внутренней (U). Для того чтобы вычислить U одноатомного газа массой m, нам необходимо произвести умножение кинетической энергии (средней) 1-го атома на общее число всех атомов. Но при этом нужно учитывать, что kNA=R. Исходя из имеющихся у нас данных, мы получаем следующую формулу: U= 2/3 х m/M х RT, где внутренняя энергия прямо пропорциональна абсолютной температуре. Все изменения U определяются только T (температурой), замеренной в изначальном и итоговом состоянии газа, и не имеют прямого отношения к объему. Это связано с тем, что взаимодействия его потенциальной энергии равны 0, и уж вовсе не зависят от других системных параметров макроскопических объектов. При наличии более сложных молекул идеальный газ также будет иметь внутреннюю энергию, прямо пропорциональную абсолютной температуре. Но, надо сказать, при этом между U и T коэффициент пропорциональности изменится. Ведь сложные молекулы выполняют не только поступательные движения, но и вращательные. Внутренняя энергия равна сумме этих движений молекул.
От чего зависит U?
Внутренняя энергия находится под влиянием одного из макроскопических параметров. Это температура. У реальных газов, жидких и твердых тел потенциальная энергия (средняя) при взаимодействии молекул не равняется нулю. Хотя, если рассмотреть точнее, для газов она много меньше кинетической (средней же). При этом для твердых и жидких тел - сравнима с ней. А вот средняя U зависит от V вещества, потому что в период его изменения меняется и среднее расстояние, которое есть между молекулами. Из этого следует, что в термодинамике внутренняя энергия зависит не только от температуры T, но и от V (объема). Их значение однозначно определяет состояние тел, а значит и U.

Мировой океан
Сложно представить, какие невероятно большие запасы энергии содержит в себе Мировой океан. Рассмотрим, что собой представляет внутренняя энергия воды. Надо отметить, что она же является тепловой, потому что образовалась в результате перегрева жидкой части поверхности океана. Так вот, имея разницу, к примеру, в 20 градусов по отношению к донной воде, она приобретает значение около 10^26 Дж. При измерении течений в океане его кинетическая энергия оценивается величиной около 10^18 Дж.
Глобальные проблемы
Существуют глобальные проблемы, которые можно поставить на мировой уровень. К ним относят:
Истощение запасов ископаемого топлива (в первую очередь нефти и газа);
Значительное загрязнение окружающей среды, связанное с использованием этих ископаемых;
Тепловое "загрязнение", плюс ко всему повышение концентрации атмосферной углекислоты, грозящее глобальными климатическими нарушениями;
Использование урановых запасов, приводящих к появлению радиоактивных отходов, которые весьма негативно сказываются на жизнедеятельности всего живого;
Использование термоядерной энергии.

Заключение
Вся эта неопределенность касательно ожидания последствий, которые непременно настанут, если не перестать потреблять энергию, добытую такими способами, заставляет ученых и инженеров уделять практически все свое внимание решению этой проблемы. Их главной задачей является поиск оптимального источника энергии, Немаловажно и задействование различных природных процессов. Среди них наибольший интерес представляют: солнце, вернее солнечное тепло, ветер и энергия в Мировом океане.

Во многих странах моря и океаны давно рассматривают как источник энергии, и их перспективы становятся все более многообещающими. Океан таит в себе немало тайн, его внутренняя энергия - это бездонный кладезь возможностей. Одно только то, сколько способов извлечения энергии он нам предоставляет (таких как океанские течения, энергия приливов и отливов, термальная энергия и другие), уже заставляет задуматься о его величии.
Все окружающие нас макроскопические тела в своем составе имеют частицы: атомы или молекулы. Находясь в постоянном движении, они одновременно обладают двумя видами энергии: кинетической и потенциальной и формируют внутреннюю энергию тела:
U = ∑ Е k +∑ Е p
В это понятие входит также энергия взаимодействия друг с другом электронов, протонов, нейтронов.
Возможно ли изменение внутренней энергии
Существует 3 способа ее изменения:
- благодаря процессу теплопередачи;
- путем совершения механической работы;
- с помощью проведения химических реакций.
Рассмотрим более подробно все варианты.

Если работу будет совершать само тело, то его внутренняя энергия станет уменьшаться, а когда работу совершают над телом, внутренняя его энергия будет увеличиваться.
Простейшими примерами увеличения энергии являются случаи добывания огня с помощью трения:
- с применением трута;
- с помощью огнива;
- с использованием спичек.


Тепловые процессы, связанные с изменениями температуры, также сопровождаются изменениями внутренней энергии. Если нагревать тело, его энергия будет возрастать.

Результатом химических реакций является превращение веществ, которые отличны друг от друга строением и составом. Например, в процессе горения топлива после соединения водорода с кислородом образуется оксид углерода. При соединении соляной кислоты с цинком выделится водород, а в результате горения водорода выделится водяной пар.
Внутренняя энергия тела будет меняться и из-за перехода электронов с одной электронной оболочки на другую.
Энергия тел — зависимость и характеристики
Внутренняя энергия является характеристикой теплового состояния тела. Она зависит от:
- агрегатного состояния, и меняется при кипении и испарении, кристаллизации или конденсации, плавлении или сублимации;
- массы тела;
- температуры тела, характеризующей кинетическую энергию частиц;
- рода вещества.
Внутренняя энергия одноатомного идеального газа
Эта энергия, в идеале, складывается из кинетических энергий каждой частицы, которая беспорядочно и непрерывно движется, и потенциальной энергии их взаимодействия в рамках конкретного тела. Происходит это благодаря изменению температуры, что подтверждают проведенные эксперименты Джоуля.
Для расчета внутренней энергии одноатомного газа пользуются уравнением:
Где в зависимости от изменения температуры будет меняться внутренняя энергия (возрастать с увеличением температуры, и уменьшаться с ее убыванием). Внутренняя энергия – это функция состояния.